Los óxidos simples son compuestos con, al menos, un átomo de oxígeno y un átomo de otro elemento. De modo que un óxido tiene una fórmula muy general del tipo XnOm, donde X es cualquier elemento de la tabla periódica. Los óxidos, a temperatura ambiente, pueden ser sólidos, líquidos o gases y su estructura puede ser molecular, polimérica o cristalina.
Los óxidos se forman cuando los distintos elementos reaccionan con el oxígeno ya sea porque se encuentran en una atmósfera rica en oxígeno o bien porque hay un aumento de calor, como ocurre en los procesos cerámicos. Esta reacción es exotérmica y puede producir llamas (por ejemplo en la oxidación del calcio o en la combustión del carbono).
Por lo general, cada átomo de oxígeno acepta 2 electrones del elemento con el que se combina y por ello se dice que su estado de oxidación es 2-. Solo en la formación de peróxidos (estado de oxidación del oxígeno -1) o en los llamados superóxidos (estado de oxidación del oxígeno -1/2) el átomo de oxígeno no se comporta con estado de oxidación -2.
Dependiendo de muchos factores, como la naturaleza electrónica del elemento X, su radio iónico, y sus valencias, pueden formarse múltiples óxidos de un mismo elemento con el oxígeno.
La cantidad de oxígeno que se combina con el otro elemento puede ser un número entero o una fracción. Por ejemplo, el Fe2O3 es estequiométrico ya que la relación X/O es ⅔, es decir números enteros tanto en el numerador como en el denominador.. Sin embargo también hay óxidos no estequiométricos en los que se combinan cantidades decimales de oxígeno y del otro elemento. Por ejemplo, el óxido X0,36O1,7 no es estequiométrico ya que la relación X/O tiene decimales tanto en el numerador como en el denominador. Este tipo de óxidos no estequiométricos se producen con elementos metálicos, sobre todo con los metales de transición (Fe, Mn, Zn, Au, Ti,…)El tipo de enlace de un óxido (iónico o covalente) depende de la diferencia de electronegatividad entre el oxígeno y el elemento con el que se combina. Cuando el elemento que reacciona con el oxígeno es un metal, X es muy electropositivo y se forman óxidos iónicos en los que se enlazan iónicamente cationes Xn+ con aniones O2-. Si el elemento que se combina con el oxígeno es un “no metal”, X es electronegativo y se forman óxidos covalentes en los que habrá enlaces covalentes simples (X-O) y enlaces covalentes dobles (X=O)
Óxidos básicos, ácidos, neutros y anfóteros
El carácter iónico o covalente de un óxido define muchas de sus propiedades, incluyendo su capacidad de formar bases o ácidos en disolución acuosa. De aquí surgen los llamados óxidos básicos y ácidos. Los que no se comporten como ninguno de los dos, o que por el contrario manifiesten ambas características, son óxidos neutros y anfóteros respectivamente.
- Óxidos básicos: Los óxidos básicos son iónicos, metálicos, y al disolverse en agua producen una solución básica. Aunque el óxido sea insoluble en el agua, basta con que se disuelva una mínima cantidad para modificar el pH. Algunos óxidos básicos son tan solubles que generan hidróxidos cáusticos como el NaOH y KOH.
- Óxidos ácidos: Los óxidos ácidos son covalentes, formados con un elemento no metálico, y además, generan soluciones ácidas con el agua.
- Óxidos neutros: Estos óxidos son covalentes, no metálicos y no forman hidróxidos, ni ácidos en solución acuosa. Algunos de ellos son: N2O, NO y CO.
- Óxidos anfóteros: Son óxidos que pueden comportarse como ácidos o básicos. No reaccionan con el agua, por lo que es necesario hacerlos reaccionar con ácidos y bases más fuertes para comprobar su comportamiento. Estos óxidos se caracterizan por reaccionar tanto con ácidos como con bases. Son ejemplos de óxidos anfóteros el óxido de aluminio (Al2O3) y el óxido de hidrógeno, es decir, el agua (H2O).
Óxidos mixtos y oxosales
Además de los óxidos simples en los que un elemento se combina con el oxígeno, puede haber óxidos mixtos que consisten en la combinación de oxígenos con cationes de varios elementos, o con varios cationes del mismo elemento pero con números de oxidación distintos.
Suelen ser compuestos iónicos y sólidos y suelen tener estructuras cristalinas o poliméricas.
Estos compuestos tienen la forma química de una sal, en la que hay un anión unido a un catión. Es decir, los “óxidos mixtos”, también denominados a veces “óxidos complejos” son compuestos que pueden englobarse dentro de los óxidos o dentro de las sales.
En algunos de estos compuestos el oxoanión (anión con oxígenos y un elemento) tiene un enlace débil con el catión y es una sal u oxisal metálica, mientras que otros compuestos son dos óxidos unidos con enlaces fuertes formando estructuras cristalinas muy estables, alejándose del concepto de sal.
Los llamados “óxidos mixtos”, por tanto, son también “oxosales” y pueden llegar a crear mucha confusión especialmente si se formulan de forma simplificada y el elemento que forma el anión y el catión de la sal es el mismo con distintos números de oxidación.
Por ejemplo el “óxido” denominado minio o plomo rojo cuya fórmula tradicional es Pb3O4, en realidad se trata de Pb2[PbO4] que es una sal llamada orto-plumbato de plomo. Algo similar ocurre con el meta-plumbato de plomo Pb[PbO3] que tradicionalmente se ha formulado como Pb2O3.
La magnetita, que siempre se ha formulado como Fe3O4, es un óxido mixto del grupo de las ferritas en la que el hierro se encuentra en dos estados de oxidación distintos formando una estructura cristalina denominada espinela. La fórmula general de las ferritas es Fe(FeX)O4, donde X es un catión divalente. La magnetita es la ferrita de hierro y su fórmula desarrollada es Fe+3(Fe+3Fe+2)O4 que es un compuesto salino denominado ferrato (III) ferroso
Cuando el elemento que forma parte del oxoanión es distinto del elemento que forma el catión de la sal, la formulación simplificada del compuesto es más intuitiva.
La ilmenita FeTiO3 es un óxido mixto que también puede formularse en forma de sal Fe[TiO3] de forma que vemos de inmediato el oxoanión [TiO3]2- y el catión de la sal Fe2+.
Los óxidos mixtos, dicho de otra forma, las oxisales son productos cerámicos que se forman durante los procesos de cocción,con múltiples elementos. Tenemos así aluminatos, antimoniatos, estannatos, zirconatos, titanatos, vanadatos, manganatos, ferratos, cupratos, cromatos, cobaltatos,….
Con la mayor parte de elementos que forman oxoaniones, junto al ion metálico con un número de oxidación determinado, el anión puede llevar distintas cantidades de oxígeno, de forma que cuanto más oxígeno forma parte del anión, mayor será su carga negativa.
Así, por ejemplo, un ion Si4+ puede combinarse con 3 oxígenos formando oxoaniones [SiO3]-2 o bien combinarse con 4 oxígenos formando [SiO4]-4. En estos casos, en la nomenclatura tradicional se utilizan los prefijos “meta” y “orto” para diferenciar las sales formadas, correspondiendo el prefijo meta a la sal con menos oxígeno y orto a la sal con más oxígeno. Es decir, las sales de silicio de la forma X[SiO3] son metasilicatos y las sales X2[SiO4] son ortosilicatos.
Esta nomenclatura puede complicarse con un nivel intermedio de cantidad de oxígeno por catión que se suele denominar con el prefijo “piro”. En el caso del silicio, el anión [Si2O7]-6 (con 3,5 oxígenos por cada silicio) podría denominarse anión pirosilicato.
En el caso del ion boro B+3 tenemos meta-boratos [BO2]-1, piro-boratos [B2O5]-4, y orto-boratos [BO3]-3.
La estructura cristalina de las sales meta piro y orto suele tener la misma forma poliédrica en su celda elemental y lo que cambia es el número de celdas elementales enlazadas entre sí para formar cada uno de los aniones. Es decir, los prefijos orto piro y meta indican la polimerización de la celda fundamental y los aniones formados también se denominan polianiones. Debido a esta polimerización, los oxoaniones con distintas cantidades de oxígeno también se denominan con los prefijos di, tri, tetra, penta… en función del número de celdas elementales que los forman. Esto ocurre, por ejemplo, con el anión cromato (VI) de fórmula [CrO4]-2 con estructura tetraédrica, que se polimeriza formando dicromatos con el anión [Cr2O7]-2 que consta de dos tetraedros que comparten un vértice entre sí.
Cuando estos compuestos tienen una estructura muy salina, el oxoanión puede cristalizar en formas diversas como tetraédrica, octaédrica, etc.. y el catión salino se une a esa estructura por enlace iónico. Cuando el compuesto tiene una estructura de óxidos fuertemente enlazados entre sí, la estructura cristalina tiene distintas formas en las que se combinan los poliedros de los óxidos que forman el compuesto.
Estas estructuras cristalinas son de enorme importancia en la cerámica. Entre las distintas estructuras cristalinas destacan la espinela y la perovskita.
La estructura cristalina de las espinelas es muy estable y consiste en una combinación de cationes coordinados en tetraedros y octaedros. El nombre de “espinela” es el nombre del mineral MgAl2O4, que para mayor claridad debería formularse como Al(AlMg)O4 y también puede denominarse aluminato de magnesio. El nombre de este mineral se extendió como nombre genérico para toda esta familia de “óxidos mixtos”.
A continuación algunos compuestos del grupo espinelas utilizando la formulación tradicional:
- Espinelas de aluminio: Espinela (MgAl2O4) que da nombre a esta clase de minerales, Gahnita (ZnAl2O4), Hercinita (FeAl2O4), Galaxita (MnAl2O4), Ceylonita y Pleonasto ((Mg, Fe) Al2O4)
- Espinelas de hierro (Ferritas): Cupro-espinela (CuFe2O4), Franklinita ((Fe, Mn, Zn) (Fe, Mn)2O4), Jacobsita (MnFe2O4), Magnesio-ferrita (MgFe2O4), Magnetita (FeFe2O4), Trevorita (NiFe2O4), Ulvö-espinela (TiFe2O4), Ferrita de zinc ((Zn, Fe) Fe2O4)…
- Espinelas de cromo: Cromita (FeCr2O4), Magnesio-cromita (MgCr2O4), Zinco-cromita (ZnCr2O4)
- Espinelas de cobalto: Manganeso-cobaltita : Mn 1,5 Co 1,5 O 4
- Espinelas de vanadio: Coulsonita (FeV2O4), Magnesio Coulsonita (MgV2O4)
Además de las espinelas, existen otras familias de “óxidos mixtos” como la perovskita que son óxidos con fórmula XYO3. Esta familia toma su nombre del mineral CaTiO3. En cerámica se forman distintos titanatos con esta estructura.
Tienen estructura de perovskita los metatitanatos de calcio CaTiO3, de magnesio MgTiO3, de bario BaTiO3, de estroncio SrTiO3, de plomo PbTiO3
Hay meta titanatos, como el de hierro FeTiO3 conocido como ilmenita, o el titanato de zinc ZnTiO3 que no adquieren esa forma cristalina sino que forman paquetes hexagonales cerrados.
Los titanatos denominados orto titanatos pueden tener estructura de espinela, como ocurre con el ortotitanato de magnesio Mg2TiO4 y al de zinc Zn2TiO4.
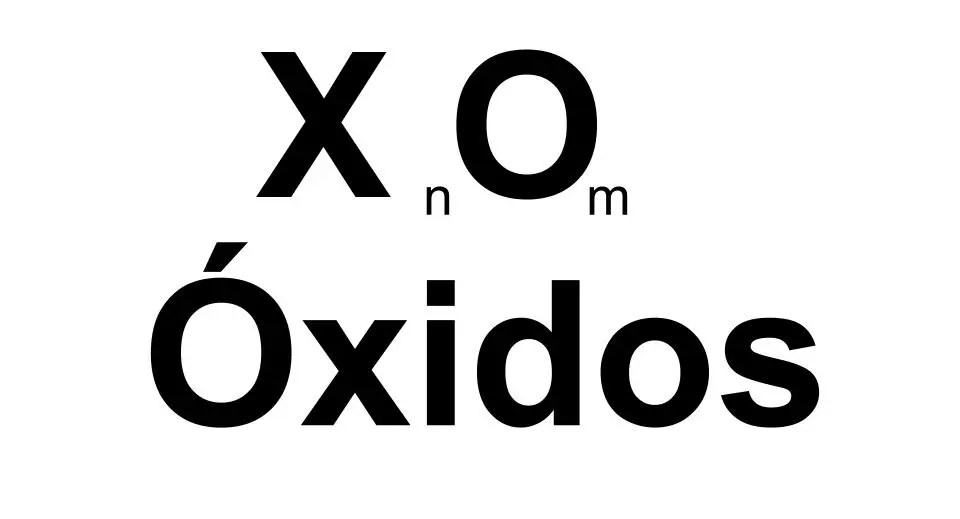
Un comentario en “Óxidos y oxosales”