Ciertos óxidos son formadores de red sólo si están en presencia de otros. Por ejemplo: Al2O3, TeO2, V2O5, SeO2, MoO3, TiO2, Bi2O3.
A estos óxidos se les denomina “formadores de vidrio condicionales” u “óxidos intermediarios” y tienen la capacidad de incorporar sus tetraedros en redes de sílice, boro, fósforo o germanio.
En cerámica, la alúmina Al2O3 es el óxido intermediario que siempre está presente, tanto en pastas como en vidriados. No ocurre lo mismo en la fabricación de vidrio, donde casi nunca se utiliza alúmina.
El catión de aluminio es Al3+ , puede comportarse como un modificador de red, con coordinación 6 octaédrica. Es decir, este catión puede realizar enlaces iónicos con oxígenos NBO de la red que se hayan producido al introducir otros iones modificadores.
Pero el catión de aluminio Al3+ también actúa con número de coordinación 4, formando tetraedros al igual que la sílice. El tamaño del tetraedro de aluminio es 0.39 Å, es decir muy similar al tamaño del tetraedro de sílice que mide 0.26 Å. Esta similitud entre aluminio y sílice hace que los tetraedros de aluminio reemplacen a determinados tetraedros de sílice en la estructura de la red vítrea. Cuando esto ocurre, se produce un desequilibrio de carga. El enlace Si-O-Al no es neutro y tiene carga negativa, por lo que se necesita que un ion alcalino o alcalinotérreo se enlace para balancear la carga.
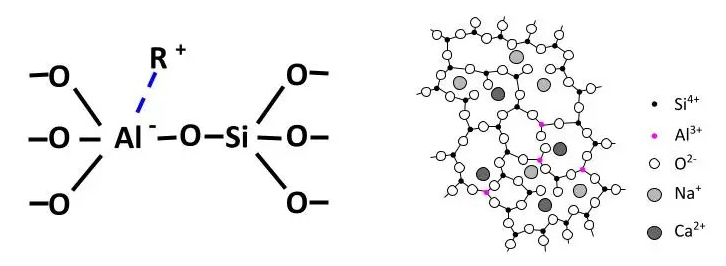
En el esquema de la derecha no se representa el cuarto oxígeno de los tetraedros
Pero además, cada molécula de alúmina aporta 3 oxígenos y para formar sus dos tetraedros se necesita un cuarto oxígeno, por lo que un NBO se convierte en BO cada vez que dos tetraedros de aluminio sustituyen a dos tetraedros de silicio. La eliminación de NBO’s fortalece la estructura de la red. Los tetraedros de aluminio, como formador de red condicional, forman parte de la red vítrea y también facilitan la integración de los modificadores, por lo que también se denominan “estabilizadores” o “intermediarios”.
La inclusión de alúmina en la red vítrea incrementa la viscosidad y el módulo elástico, a la vez que disminuye el coeficiente de expansión térmica, y facilita la difusión de iones alcalinos y alcalinotérreos.
Si la cantidad de alúmina añadida supera la cantidad de iones alcalinos/alcalinotérreos, la alúmina en exceso no podrá ser neutralizada a nivel de carga eléctrica y se formarán oxígenos tri-coordinados. Es decir, cada Al3+ en exceso genera 3 oxígenos NBO en este caso.
Otro óxido intermediario es el óxido de plomo PbO. Este óxido actúa como modificador de red, siendo un potente fundente. Su coordinación es cúbica y su ión Pb2+ tiene un radio atómico muy grande (1,32 Å). Sin embargo, el óxido de plomo es capaz de incorporarse en la red vítrea en forma de celdas piramidales del tipo PbO3 o PbO4, actuando así como óxido intermediario.
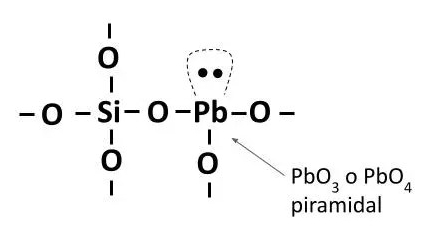
La cantidad de plomo presente hace que el comportamiento y las propiedades de la estructura vítrea sean muy distintas. Para pequeñas concentraciones de plomo tendrá comportamiento de intermediario y la estructura vítrea tendrá buena resistencia a los ataques químicos. Con mayor presencia, el plomo se empieza a comportar fundamentalmente como modificador, rebajando la temperatura de fusión y acentuando su solubilidad (por lo que hay riesgo de lixiviación). En cerámica, los vidriados de plomo pueden llegar a tener un 90% en peso de PbO, por lo que su actividad predominante es la de modificador fundente. intermediario.
Al igual que el aluminio y el plomo, los óxidos opacificantes de titanio TiO2, de estaño SnO2, de zirconio ZrO2 y de zinc ZnO son también óxidos intermediarios que forman tetraedros que pueden introducirse en la red vítrea de la sílice.
Entre los óxidos de metales de transición empleados como colorantes también parece demostrada su función como óxidos intermediarios. Destacan en este grupo el vanadio, el hierro, el manganeso y el cobalto.
Por ejemplo, el hierro, forma sales o ferratos cuyos aniones son estructuras tetraédricas con oxígenos en los vértices que se introducen en la red vítrea del silicio.
Los óxidos de arsénico As2O3 y antimonio Sb2O3 son capaces de formar vidrios si se enfrían muy rápidamente y otros elementos cercanos cuyos óxidos tienen la forma R2O3 también se comportan como óxidos intermediarios aunque su uso en cerámica es muy escaso o inexistente (Ga2O3, Se2O3, Te2O3) excepto el óxido de bismuto Bi2O3 que se emplea como fundente y puede llegar a sustituir al plomo en muchas aplicaciones.
Un comentario en “Óxidos intermediarios”