El cromo se emplea como cromóforo en cerámica. Su color característico es el verde de cromo, aunque también produce rojo, naranja, amarillo, rosa y marrón.
El único óxido de cromo estable es el Cr2O3 que se suele extraer de un mineral llamado cromita con estructura de espinela (FeCr2O4). Los cromatos también se usan para obtener Cr2O3, pero todos ellos son solubles en agua, por lo que su uso se limita a la obtención de fritas y para algunos casos especiales.
El Cr2O3 es un óxido anfótero y no es fundente sino refractario. Su presencia hace que los vidriados aumenten la temperatura de fusión y la viscosidad. Debido a su refractariedad suele permanecer sin fundir y se dispersa en el vidriado creando un color opaco. Sólo cuando su presencia es inferior al 2% y está bien molido es capaz de disolverse en la matriz vítrea, pero con mayores cantidades produce opacidad.
Puede utilizarse a cualquier temperatura pero alrededor de 1240ºC se volatiliza, contaminando todas las piezas que estén en el horno. Los vidriados blancos con CaO y SnO2 se vuelven rosas o rojos, los vidriados de titanio se vuelven rosa amarillento y los de zinc se vuelven marrones. Los vapores de cromo son muy venenosos 💀
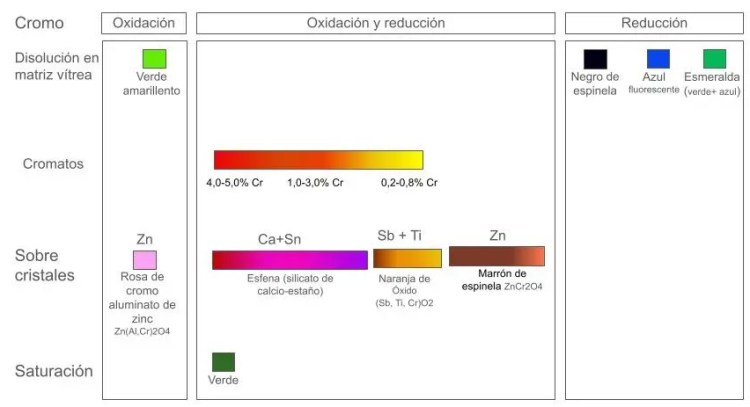
Este óxido tiene idéntico comportamiento en oxidación y en reducción excepto para los rosas de cromo que no sobreviven a la reducción.
Durante la cocción el Cr2O3 se transforma en 2CrO3 capturando oxígeno, tanto en oxidación como en reducción. El CrO3 así formado reacciona con otros óxidos para formar cromatos de colores rojo/naranja/amarillo, principalmente con óxido de plomo, con los alcalinos y también con el bario. Por ejemplo, en vidriados de plomo se produce el cromato (VI) de plomo con la reacción:
CrO3 + PbO → Pb[CrO4]
Según aumenta la temperatura los cromatos (VI) de Cr+6 se disuelven y se transforman en orto-cromato (IV) cromoso con fórmula Cr2[CrO4] o en meta-cromato (IV) cromoso Cr[CrO3] si están presentes iones de radio atómico grande como el potasio, liberando oxígeno en ambos casos. Los aniones [CrO4]-4 y [CrO3]-2 tienen estructura tetraédrica y se integran en la matriz vítrea como óxidos intermediarios (formadores de red condicionales). Los iones Cr+2 que actúan como catión de la sal son incoloros. Los aniones tetraédricos meta producen color verde amarillento y los orto también aunque con tonalidad más azulada.
En reducción el Cr+4 solo se reduce a Cr+3 porque cuando se reduce a Cr+2 (muy reductor) se ceden 2 electrones a la vez volviendo al estado Cr+4. Como resultado de la reducción se obtiene cromato (III) cromoso Cr[Cr+3 O2]– que es un cristal semejante a la espinela de color negro que queda flotando en la la matriz vítrea. Solo si la reducción es muy radical se puede llegar a conseguir que algunos iones pasen a la forma elemental Cr0 que es de color azul fluorescente. La mezcla de este azul con el verde amarillento de los aniones que sobreviven a la reducción forma el color esmeralda.
En general, el cromo comienza a dar color en los vidriados añadiendo un 0,1%, lo habitual es añadir entre el 1 y el 4% en peso, y llega a la saturación con cantidades alrededor del 5% en peso.
Respuesta al color
Los colores del cromo son los siguientes:
Verde amarillento por disolución en la matriz vítrea: En presencia de 1% o 2% se disuelve bien, pero a mayores proporciones suele quedar sin disolver, a no ser que se emplee plomo en la composición del vidriado ya que éste facilita la disolución del cromo formando cromatos.
Verdes de cromo: Los cristales de óxido de cromo sin disolver son los responsables del color verde de cromo y basta con un 1% para lograr un verde fuerte. Este verde puede ser verde hierba (con calcio), verde pavo real (con magnesio y cobalto),.. En cocciones fuertemente reductoras se forma verde esmeralda debido a la combinación del verde amarillento con el azul fluorescente de los átomos neutros.
Rojos, naranjas y amarillos de cromato (VI): Los cristales de cromato son los responsables de las coloraciones rojas, naranjas y amarillas El cromato suele ser de plomo pero también puede ser de alcalinos, de bario, de calcio, etc… Los cromatos se disuelven a temperaturas cercanas a los 1040ºC.
Rojos, rosas y lilas de Ca+Sn+Cr: La esfena de calcio y estaño es un silicato que se colorea con pequeñas cantidades de cromo (Ca+Sn+Cr) produciendo colores rojos y rosas. Se obtienen lilas y púrpuras añadiendo boro.
Naranjas de Sb+Ti+Cr: Los vidriados con antimonio y titanio a los que añadimos vestigios de cromo forman un óxido no estequiométrico (Sb,Ti,Cr)O2 que se percibe de color naranja.
Marrón, marrón anaranjado y rosa: El zinc y el cromo forman una espinela muy estable de color rosa en oxidación y pardo en reducción. Si además tenemos antimonio presente, se obtienen tonos anaranjados. La espinela parda de zinc y cromo es el motivo de que no se pueda desarrollar el verde de cromo en presencia de zinc (o con mucho calcio).
Negros con cromo: El cromo también se emplea para formar negros, estando presente en un 40% en las mezclas de cromo cobalto y hierro, y llegando hasta un 65% en las mezclas de cromo y cobre.
Materias primas
Todas las materias primas de cromo son tóxicas 💀 . Todos los cromatos son hidrosolubles y el cromo se introduce casi siempre en forma de óxido, excepto cuando se aplican cromatos disueltos directamente sobre las piezas ya cocidas.
También se pueden utilizar otros materiales como cloruro de cromo (III) hexahidratado CrCl2·6H2O, nitrato de cromo (III) hidratado Cr(NO3)3·9H2O, el óxido de cromo (VI) CrO3, o la cromita que es un mineral de cromo y hierro con fórmula FeCr2O4.
Óxido de Cromo: 💀 Cr2O3 . Es el único óxido estable de cromo. Es el verde de cromo (de color verde oliva oscuro). Es tóxico.
Cromato de plomo: 💀 PbCrO4. Cromato de plomo o amarillo de cromo (de color naranja amarillento). Es tóxico
Cromato y Dicromato potásico: 💀 El cromato potásico K2CrO4 y el dicromato potásico K2Cr2O7 son tóxicos y solubles en agua. Materiales de color amarillo y naranja rojizo, respectivamente, que suelen utilizarse para introducir el cromo necesario para los rojos de cromo de baja temperatura que se obtienen con vidriados de plomo, en efectos tipo aventurina, y en la obtención de rosas Cr-Sn.

Un comentario en “Cromo”