El óxido de hierro es el colorante más común de la cerámica. Es tan ubicuo que es difícil encontrar una materia prima que no contenga algo de hierro. Podemos encontrarlo en casi todo, desde los feldespatos al caolín y la arcilla de bola, en arcillas de baja temperatura o en muchos colorantes.
Los dos óxidos presentes en cerámica son el óxido de hierro rojo Fe2O3 y el óxido de hierro negro FeO y como materia prima para vidriados y pastas se emplea fundamentalmente el óxido de hierro rojo.
Óxido de hierro rojo Fe2O3: Es un óxido anfótero y refractario. Los vidriados en oxidación de hierro rojo pueden tener un contenido de alúmina muy bajo pero no se escurren porque el hierro actúa como la alúmina estabilizando y endureciendo la masa fundida. Cristaliza formando hematites.
Óxido de hierro negro FeO: Es un fundente potente. El óxido de hierro negro se produce cuando se reduce el Fe2O3 mediante la siguiente reacción:
Fe2O3 + CO → 2FeO + CO2.
Durante la cocción siempre conviven en mayor o menor medida ambos óxidos ya que el calor hace que se produzcan las siguientes reacciones:
3FeO + calor → Fe2O3 + Fe°
2Fe2O3 + calor → 4FeO + O2
También pueden formarse óxidos complejos con estructura de espinela denominados ferritas. La ferrita más conocida es la magnetita con fórmula Fe+3(Fe+3Fe+2)O4 , que es ferrato (III) ferroso y que se suele formular como Fe3O4 de forma abreviada (aunque esta formulación simplificada puede inducir a error). Si se añade a un vidriado permanece mayoritariamente en forma cristalina y producen colores negro o gris plata. Se utiliza magnetita para lograr moteados en las pastas o las llamadas “lentejuelas” en algunos vidriados.
El hierro es un metal muy activo que se combina fácilmente con el oxígeno. Esto significa que es muy sensible a la atmósfera oxidante o reductora.
La disolución de los óxidos de hierro (Fe2O3 y FeO) se produce con el aumento progresivo de temperatura, transformándose ambos en orto-ferrato (IV) ferroso con fórmula Fe2[FeO4] liberando también Fe0 en el caso de FeO.
El óxido FeO comienza a convertirse en Fe2[FeO4] a una temperatura relativamente baja, pero el Fe2O3 no hace esta transformación en forma masiva hasta alcanzar los 1232ºC, por lo que se mantiene en gran parte cristalino hasta alta temperatura.
4FeO + calor → Fe2[FeO4] + Fe0
6Fe2O3 + calor (1232º) → 4Fe2[FeO4] + O2
El anión [FeO4]-4 produce color amarillo verdoso. Los iones Fe+2 son incoloros El átomo elemental Fe0 es de color azul. El resultado cuando hay mucho FeO presente es un amarillo verdoso azulado. Por otro lado, la disolución del Fe2O3 libera oxígeno en forma de burbujas a las que se adhiere Fe2O3, si está en saturación, de forma que al llegar a la superficie la burbuja escapa y deja manchas de hierro que son las “manchas de aceite” de los vidriados tenmoku, o los “riachuelos» de los tenmoku piel de liebre.
En presencia de potasio, se obtiene meta-ferrato (IV) ferroso con fórmula Fe[FeO3] de color verde azulado en equilibrio con el Fe0 de color azul.
Los aniones [FeO4]-4 y [FeO3]-2 tienen estructura tetraédrica y se integran en la red vítrea de la sílice con la función de óxidos intermediarios (formadores de red condicionales), mientras que los cationes Fe+2 realizan la función de modificadores de red.
En reducción, el Fe2O3 se reduce a FeO a partir de 900ºC, el cual acaba reduciéndose a Fe0 de color azul que puede mezclarse con los restos de amarillo verdoso y verde azulado de aniones que no llegan a reducirse y con el rosa de los cationes Fe+3 obtenidos por el efecto fotoeléctrico de los rayos UV de la luz solar.
Los átomos neutros Fe0 pueden formar partículas metálicas de color gris.
En los vidriados, el Fe2O3 comienza a dar color con un 1%, se suele añadir entre el 2 y el 12% en peso, y llega a la saturación con cantidades alrededor del 25-30% en peso.
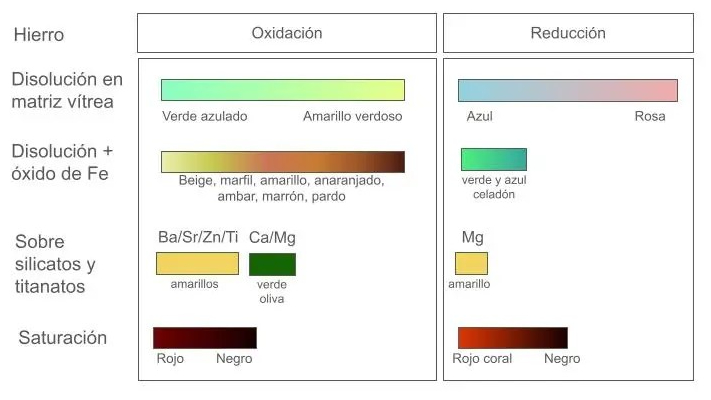
La variedad de colores que produce el hierro se debe fundamentalmente a que conviven en cantidades variables el hierro disuelto en la matriz vítrea con cristales de óxido. Podemos decir que el carácter de los vidriados de hierro queda determinado por la cantidad de hierro presente. Así tenemos:
- Poca cantidad de hierro: Predomina la disolución de los óxidos. Son así los amarillos y beige de hierro en oxidación, verdes azulados y azules de hierro en reducción.
- Cantidades medias de hierro: El color rojizo de los cristales de Fe2O3 comienza a tener presencia notable. Naranjas de hierro, marrones-rojizos y marrones de hierro
- Cantidades altas de hierro: rojos y negros de hierro por la presencia de muchos cristales que se precipitan tras la fusión (Tenmokus, Seto negro, kaki,…).
- Alta Saturación del hierro: hay partículas de óxido que no llegan a la fusión y también se precipitan cristales durante el enfriamiento. La superficie se vuelve áspera y rugosa.
Los cristales de Fe2O3 se llaman hematites, al igual que un mineral cuya composición es también óxido de hierro cristalizado. Los vidriados cristalinos de hierro se llaman “aventurinas” y en ellos el tamaño de los hematites es grande y se pueden apreciar a simple vista.
El óxido Fe2O3 es bastante refractario, por lo que suele permanecer inerte durante la cocción sin llegar a la fusión, si está en saturación alta. Se obtiene así una superficie opaca y mate.
En todos los vidriados de hierro con cristalizaciones de Fe2O3 se pueden producir “azules Chun» cuando los cristales son suficientemente pequeños.
En general, los vidriados de hierro varían su color cuando se presentan irregularidades en la capa de vidriado.
Respuesta al color
Los colores del hierro son:
Marfil, pajizo, amarillo, anaranjado, ambar (color miel), marrón: En baja temperatura, según la concentración de Fe2O3 aumenta desde 0,5% hasta 5%, fruto del amarillo del hierro disuelto mezclado progresivamente con el rojo del Fe2O3 cristalino.
Amarillos en alta temperatura en vidriados ricos en calcio, bario, estroncio, zinc, rutilo y titanio. Amarillos en reducción en vidriados con magnesio (y también calcio).
Rojos en baja temperatura sobre vidriados alcalinos (rojo herrumbre o marrón rojizo) o de plomo. El rojo se torna anaranjado en ausencia de calcio, o bien realizando la cocción en reducción (rojo coral).
Rojos “kaki” en alta temperatura en vidriados en reducción con Ca/Mg.
Cristalinos rojos: Los vidriados cristalinos aventurina en baja temperatura suelen ser rojos, aunque también pueden ser marrones y negros, sobre vidriados alcalino borácicos. Los vidriados “Tessha” de lentejuelas de hematites suelen estar entre marrón rojizo y púrpura oscuro.
Verdes: Verde oliva en vidriados ricos en calcio en oxidación y Verde celadón en reducción.
Azules: Azul hielo producido por disolución con muy poco hierro en reducción.
Marrones: En oxidación con saturación de hierro. En reducción fuerte, se obtienen vidriados oscuros (marrón oscuro y negro) muy fluidos y brillantes
Negros: Negro tenmoku en oxidación y reducción con adiciones entre el 8% y el 15% de Fe2O3.
Materias primas
Las materias primas más utilizadas para obtener óxido de hierro son el óxido de hierro rojo sintético Fe2O3 y el óxido de hierro negro (FeO).
En ocasiones también se emplean algunas sustancias hidrosolubles como Nitrato de hierro Fe(NO3)·9H2O, sulfato de hierro FeSO4·7H2O, o cloruros de hierro FeCl2 ó FeCl3.
Óxido de hierro rojo: Fe2O3 También llamado óxido de hierro (III), óxido férrico, hematita o rojo herrumbre. La forma mineral se conoce como hematita u oligisto, y la forma hidratada se denomina óxido de hierro amarillo o limonita. Su forma impura se denomina óxido de hierro púrpura o crocus martis.
En cerámica es más común el uso de la variedad sintética de hierro rojo.
La Hematita u Oligisto (Fe2O3) es el nombre que engloba una variedad de menas de hierro rojo de gran pureza, en las que puede considerarse que su composición es 99% Fe2O3.
La Limonita, también conocida como óxido de hierro amarillo, es una forma hidratada de óxido de hierro, 2Fe2O3 ·3H2O, o lo que es lo mismo Fe(OH)3, que tiene un color variable desde el amarillento hasta el naranja o rojo oscuro y que se descompone en Fe2O3 por encima de 500º. La variedad amarillenta se conoce como ocre amarillo y se disgrega fácilmente. Las variedades más oscuras se conocen como sombra o siena y son más compactas. Se trata de un compuesto sintético de partículas de tamaño muy fino (pero no tan fino como el negro o el rojo). No colorea vidriados pero si colorea pastas. Suele utilizarse como engobe.
El óxido de hierro púrpura o crocus martis, que suele ser un sulfato de hierro FeSO4 soluble o calcinado, suele producir motas en los vidriados o pastas debido a las impurezas, normalmente de titanio. Añadiendo un 3-6% se obtienen amarillos suaves en vidriados de plomo y tonos verdosos en vidriados de boro.
Óxido de hierro (II,III): Magnetita y es una formación cristalina tipo espinela. En su forma mineral, la magnetita, también llamado piedra imán, de color grisáceo plateado provoca coloración azul negruzca metálica o de color negro en las arcillas y engobes y moteados y texturas debido a su grueso tamaño de partícula.
Óxido de hierro negro: FeO. óxido ferroso u óxido de hierro (II). Provoca coloración grisácea en las arcillas. No suele utilizarse como materia prima y se prefiere utilizar el Fe2O3.
Carbonato de hierro: también denominado siderita o espato de hierro con fórmula FeCO3
Titanato de hierro: Ilmenita FeO·TiO2. Se utiliza como colorante para vidriados pero, al ser muy duro y de grano relativamente grueso, produce efectos de textura como puntos y moteados que se disuelven en mayor o menor medida en el vidriado.
Pirita: FeS2, sulfuro de hierro. No se utiliza en cerámica pero es una impureza común en las arcillas.
Cromato de hierro: FeCrO3 También llamado cromita, es un compuesto tipo espinela que puede utilizarse como colorante en los vidriados, produciendo opacidad y tonos grises y también para conseguir negros junto a los óxidos de cobalto y manganeso. Es parcialmente soluble y venenoso. No debe utilizarse por encima de 900º.
Rutilo e Ilmenita: Óxido de titanio con una cantidad variable de impurezas de hierro que pueden llegar hasta el 15%. Cuando la proporción de hierro es más elevada tenemos la ilmenita, cuyo efecto colorante es mayor que el del rutilo.

Un comentario en “Hierro”