Los sólidos, en general, tienen una estructura cristalina ordenada ya que los átomos se colocan de forma que su posición es la óptima para neutralizar las fuerzas de atracción y repulsión entre ellos. Los sólidos cristalinos poseen un patrón entre sus átomos y/o iones que se repite periódicamente.
Cuando calentamos un sólido a suficiente temperatura, se produce un cambio de estado, pasando de sólido a líquido fundido. La estructura cristalina desaparece debido a que la absorción de calor provoca la ruptura de los enlaces. Cuando enfriamos para volver al estado sólido, los átomos intentan re-ordenarse para volver a formar de nuevo un cristal.
Pero esto, no siempre llega a ocurrir.
Si el líquido fundido es viscoso, los átomos tendrán dificultad para moverse y, si la velocidad de enfriamiento del líquido es alta, no tendrán tiempo para colocarse en su posición cristalina, obteniendo así un sólido amorfo, con estructura vítrea, en la que los átomos no tienen un órden de largo alcance.
El vidrio y los vidriados cerámicos son amorfos. La cerámica, sin embargo, está formada por partículas cristalinas sinterizadas, pero también zonas más o menos vítreas debido a la fase líquida que se produce durante la sinterización.
Si en una cocción cerámica aumentamos la temperatura más allá de la sinterización y llegamos a la temperatura de fusión de todos los componentes, se perdería toda estructura cristalina y solo tendríamos una única estructura amorfa como ocurre con los vidriados de arcilla.
En los sólidos amorfos los átomos no están totalmente desordenados. Si observamos una arcilla, veremos sus cristales formados por tetraedros de silicio unidos entre sí por 3 vértices, formando hojas o láminas. Algo así:
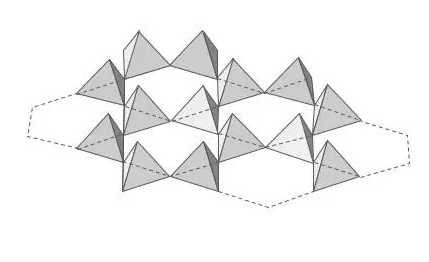
Cuando fundimos la arcilla y la enfriamos rápidamente, como ocurre con los vidriados de arcilla, en la estructura vítrea obtenida siguen existiendo los tetraedros (orden de corto alcance), pero la unión entre ellos ya no sigue ningún patrón (ya no hay orden de largo alcance). Algo así:

Este “desorden” no impide que se realicen enlaces muy fuertes. Los distintos átomos se posicionan de forma que tengan balanceada su carga eléctrica, y minimizan la energía necesaria para enlazarse entre sí llenando sus orbitales de enlace. Si algún átomo queda desbalanceado siempre busca atraer iones que se sitúen cerca y que neutralicen su carga.
Aunque la estructura de un sólido amorfo es desordenada, hay muchas similitudes con la estructura cristalina. Los números de coordinación, la longitud de los enlaces y los ángulos de los enlaces son prácticamente iguales a los de la estructura cristalina.
¿Qué materiales cristalinos pueden transformarse en sólidos amorfos?
Se han realizado muchos estudios para responder a esa pregunta. El primer estudio lo realizó Goldschmidt en 1926, aunque fue Zachariasen en 1932 quien formuló las primeras reglas para determinar qué óxidos pueden formar una red vítrea.
Según Zachariasen, los óxidos capaces de formar una red vítrea deben partir de poliedros con número de coordinación bajo, que comparten vértices en lugar de compartir aristas o caras que formarían estructuras cristalinas muy fuertes. Se descartan así los óxidos cristalinos iónicos. Los formadores de vidrio son los que tienen enlaces covalentes en su estructura cristalina.
Por otro lado, Zachariasen argumentó que las energías de los estados vítreo y cristalino de los óxidos que forman vidrio no deben ser muy diferentes. Esto significa que ambos (sólido cristalino y vítreo) tienen el mismo tipo de poliedros, pero en el sólido amorfo hay variaciones de los ángulos de enlace que se forman entre los poliedros adyacentes.
De esta forma, Zachariasen, formuló sus pensamientos como reglas para la formación del vidrio, definiendo que el óxido con fórmula XmOn debe cumplir las siguientes características para ser formador de vidrio :
- Cada átomo de oxígeno no puede estar enlazado a más de dos átomos de X (catión).
- El número de átomos de oxígeno que rodean los cationes X debe ser pequeño (3 ó 4).
- Los poliedros de oxígeno comparten solo vértices entre sí, ni aristas ni caras.
- Se deben compartir al menos tres vértices en cada poliedro.
El modelo de Zachariasen define un vidrio como una red extendida de poliedros de oxígeno que comparten esquinas, que carecen de periodicidad y cuya energía es comparable a la de la red cristalina ordenada correspondiente.
En la actualidad se conocen otras formas de lograr materiales amorfos, además de la que utiliza óxidos de alta viscosidad como los descritos por Zachariasen. El uso de materiales con moléculas muy grandes, como ocurre con polímeros de cadenas largas [-(CH2)n -], que impiden la formación de una estructura cristalina es otra forma de obtener sólidos amorfos. También el uso de materiales con estructuras variables que durante el enfriamiento pueden formar distintas estructuras sin que ninguna de ellas llegue a predominar (como ocurre con ciertas sales complejas y con nitratos Ca(NO3)2 + KNO3), puede formar sólidos amorfos.
En los procesos cerámicos y en los vidriados, las estructuras amorfas o vítreas se basan en óxidos formadores de red como los descritos por Zachariasen.
Hay cuatro elementos cuyos óxidos son capaces de formar una red vítrea por sí solos. Estos elementos son el silicio, el boro, el fósforo y el germanio.
- El Silicio es siempre el elemento cuyo óxido es el formador de red utilizado en cerámica.
- El Boro acompaña al Silicio en algunos vidriados realizando la función de formador de red auxiliar, a la vez que realiza la labor de fundente.
- El Fósforo produce un vidrio de baja calidad y muy soluble, por lo que su uso cerámico se limita a ciertos vidriados especiales.
- El Germanio no se utiliza en cerámica, fundamentalmente por su elevado precio, y su vidrio podemos encontrarlo en la industria óptica ya que se utiliza para fabricar lentes gran angulares y lentes de microscopio.
Hay otros óxidos que no pueden formar una red por sí mismos, pero pueden incorporarse a una red que ya exista. Son los óxidos formadores de red condicionales, también llamados óxidos intermediarios u óxidos estabilizadores. El óxido de aluminio Al2O3 es el óxido intermediario más utilizado en cerámica.
La temperatura de fusión de la sílice es demasiado elevada y por eso se utilizan modificadores de red (óxidos alcalinos, alcalinotérreos, etc..) que rebajan esa temperatura actuando como fundentes.
En resúmen, en una estructura vítrea o amorfa los óxidos que intervienen pueden realizar tres funciones distintas:
- óxidos formadores de red
- óxidos intermediarios, formadores de red condicionales
- óxidos modificadores de red
Sin olvidar que durante el proceso de formación de la estructura vítrea siempre deben cumplirse unas condiciones cinéticas para evitar la cristalización en el enfriamiento.
