La sílice SiO2 es el formador de vidrio que siempre se utiliza en cerámica y en los vidriados cerámicos.
Pero también suele ser habitual que junto al SiO2 se utilice como formador de red auxiliar el óxido de boro B2O3. Este óxido forma unidades triangulares planas (BO3)3-, en las que el átomo de boro está ligeramente fuera del plano de los tres átomos de oxígeno. Los distintos triángulos se enlazan a través de sus vértices entre sí, mediante oxígenos compartidos BO.
Sin embargo, el boro, en presencia de modificadores de red (alcalinos o alcalinotérreos) es también capaz de formar tetraedros (BO4)5- que utilizan los iones de los modificadores para compensar su desbalance de carga.
En una red vítrea con boro, si se añaden modificadores de red en una pequeña proporción, la red comienza a tener unas mejores prestaciones hasta que se alcanza una presencia de modificadores crítica a partir de la que la red vítrea empieza a perder calidad. Este efecto se debe a la llamada “anomalía del boro” .
El efecto se debe a que el boro comienza teniendo unidades triangulares (BO3)3- , pero según se introduce oxígeno adicional por los modificadores, se empiezan a construir estructuras en las que se mezclan triángulos con tetraedros (BO4)5- que construyen una red vítrea más rígida que los triángulos.
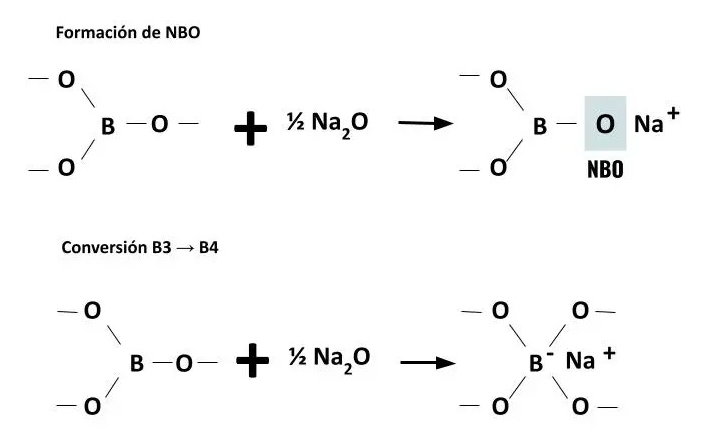
Es decir, la introducción de modificadores genera oxígenos NBO que rompen las cadenas de boro, pero según se van formando oxígenos NBO, es más probable que el boro alcance su estructura tetraédrica convirtiendo NBO’s en BO’s.
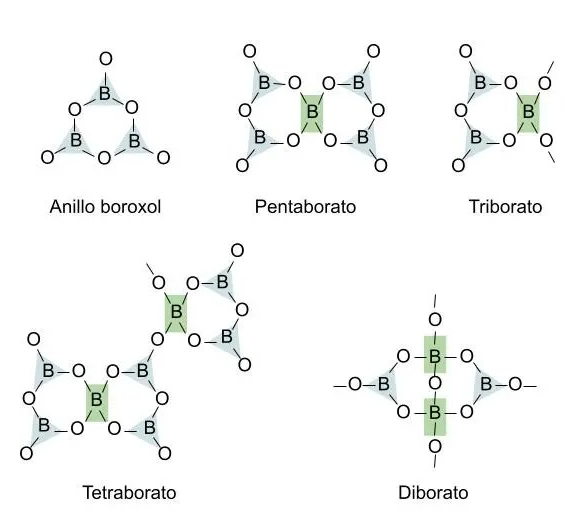
No todo el boro se puede convertir en tetraedros y se forman estructuras de tipo diborato, triborato, tetraborato y pentaborato. Primero se van reemplazando grupos boroxol por grupos pentaborato y triborato, que pueden llegar a unirse para formar tetraboratos, y según aumenta la presencia de modificadores comienzan también a formarse grupos diborato.
Si el boro añadido es una cantidad grande, llega un momento que ya no hay NBOs disponibles en la estructura y solo se producirán triángulos B3+ por lo que volverá a empeorar la calidad de la red vítrea.
En cerámica, el boro se utiliza en la formulación de vidriados como formador auxiliar del silicio. Se puede generalizar el cambio de comportamiento del boro, ya que en la fórmula Seger de un vidriado los modificadores siempre son 1 mol, estableciendo un límite en la presencia de boro en el vidriado, que puede estar alrededor del 14% . A partir de esa cantidad los principales cambios que se producen son:
- menor conectividad de la red vítrea
- aumento del coeficiente de expansión térmica
- menor resistencia térmica y a ataques químicos
- disminución de la viscosidad en alta temperatura
Por el contrario, cuando el boro está presente en el vidriado en menos de un 14%, se producen muchos cambios a estructura tetraédrica BO4 por lo que las propiedades de la red vítrea son:
- mayor conectividad de la red vítrea
- reducción del coeficiente de expansión térmica
- mayor resistencia térmica y a ataques químicos
- aumento de la viscosidad en baja temperatura
Dentro de la matriz vítrea formada por el silicio, el boro aparece con pequeñas estructuras que se dispersan de forma aleatoria y flotando en la red de sílice, formando grupos bóricos de pequeño número de átomos.
Por otro lado, no hay que olvidar que el boro se funde a muy baja temperatura, por lo que acelera la fusión de todos los componentes del vidriado. Importante tener en cuenta que los modificadores de red son siempre fundentes, pero el boro también es fundente aunque no sea modificador sino formador de red.
Además de sílice y óxido bórico, en los vidriados y en algunas pastas podemos encontrar P2O5 que es otro formador de vidrio. El P2O5 forma vidrio en base al tetraedro fosfato (PO4), el cual se une mediante enlaces covalentes con otros tetraedros formando la red vítrea, pero se mantiene independiente de la red formada por la sílice.
El principal problema de la estructura vítrea del fósforo es su solubilidad. Los vidrios de fósforo son altamente solubles y por tanto inestables, y su uso siempre va acompañado de óxidos modificadores y estabilizadores que disminuyen la velocidad de disolución del vidrio. La solubilidad se debe a que el tetraedro de fósforo tiene un doble enlace con uno de los oxígenos, por lo que ese oxígeno no puede enlazarse con otros tetraedros (es un oxígeno NBO), lo cual debilita la red vítrea
La presencia de modificadores de red alcalinos hace que se incremente el número de NBO’s extremando la debilidad de esta red. Los alcalinotérreos, en particular, el CaO, mejoran las características de solubilidad del P2O5. El óxido TiO2 también mejora bastante el problema de solubilidad del P2O5.
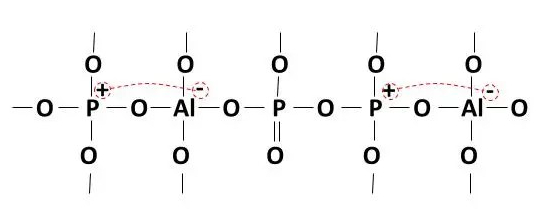
La alúmina (óxido intermediario o estabilizador) es el óxido que más favorece la red vítrea del fósforo. Los tetraedros de alúmina se intercalan con los tetraedros de PO4 y dan estabilidad al vidrio eliminando los NBO de la red. Cuanto más alúmina forme parte del vidrio de fósforo, menos NBO tendremos y se mejorarán las características del vidrio.
Un comentario en “Óxidos formadores de red”